Transformations nucléaires
II - La radioactivité
1) Rappels
a) Constitution de l'atome
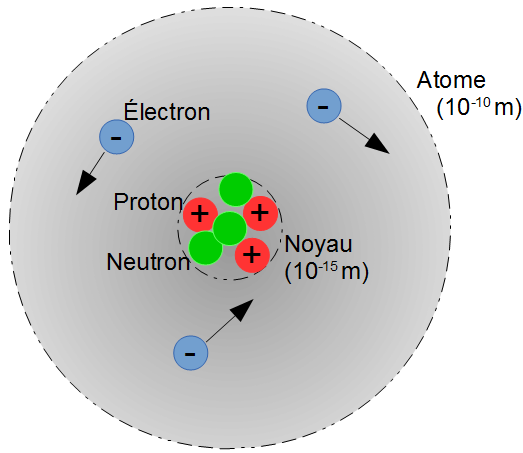
- Un atome est composé d'électrons tournant autour d'un noyau.
Dans le noyau se trouvent les protons et les neutrons : les nucléons - Les protons possèdent une charge électrique positive :
1,6x10-19C (coulomb). - Les électrons possèdent une charge électrique négative :
-1,6x10-19C (coulomb). - Les neutrons ne possèdent pas de charge électrique.
- Les protons et les neutrons ont à peu près la même masse :
mp ≃ mn = mnucléon = 1,67 × 10-27 kg. - Les électrons sont 1500 fois plus légers :
me = 9,1 × 10-31 kg.
b) Symbole du noyau
Le noyau atomique est représenté par un symbole :
Z : c'est le numéro atomique ou nombre de protons.
A : c'est le nombre de nucléons, appelé aussi nombre de masse.
Exemple : Un noyau possède 27 nucléons dont 14 neutrons. Représenter son symbole.
Si deux noyaux ont le même nombre de protons, mais un nombre de neutrons différent (donc même Z mais A différents), alors ils sont appelés isotopes d'un même élément.
Ex : Le carbone compte 3 isotopes : 12C (98,93% du carbone sur Terre), 13C (1,07% du carbone sur Terre) et 14C (radioactif et présent à l'état de traces).
2) La radioactivité
a. Définition
Dans la nature, la plupart des noyaux sont stables, car l'interaction forte maintient dans le noyau les protons et les neutrons ensemble.
Cependant, certains noyaux comportant un trop grand nombre de protons par rapport aux neutrons, ou bien un trop grand nombre de neutrons par rapport aux protons voire une trop grande nombre de protons et de neutrons seront instables et se désintègreront spontanément en un nouveau noyau plus stable au bout d'un temps plus ou moins long en émettant un rayonnement sous forme de particules chargées et souvent, d'ondes électromagnétiques.
La radioactivité est la désintégration spontanée et aléatoire des noyaux atomiques instables en noyaux plus stables.
b. Un phénomène naturel
Aux origines de l'Univers, les seuls noyaux qui existaient étaient des noyaux d'hydrogène et d'hélium.
Tous les autres éléments ont été fabriqués par les premières générations d'étoiles, fusionnant progressivement les noyaux d'hydrogène et d'hélium pour donner tous les éléments que nous connaissons actuellement.
Ainsi, nous sommes tous constitués d'atomes produits il y a des milliards d'années dans la fournaise d'une étoile qui a explosé...
Les poussières et astéroïdes qui ont formés la Terre contenaient des éléments radioactifs et ce sont actuellement eux les principaux responsables de la radioactivité terrestre.
D'ailleurs, sans radioactivité naturelle, la Terre se serait refroidie depuis longtemps, car c'est elle qui explique à l'heure actuelle la température du centre de la Terre (5300°C).
La radioactivité est donc essentiellement un phénomène naturel.
La radioactivité artificielle
Depuis une centaine d'années, l'Homme est capable de fabriquer des noyaux radioactifs par collision de particules dans des accélérateurs : on parle alors de radioactivité artificielle.
Exemple : En médecine nucléaire on injecte au patient un isotope radioactif d'un élément inoffensif pour le corps, comme de l'iode 131.
L'isotope radiocatif ayant exactement les même propriétés chimiques que l'isotope stable, il ne peut être dangereux chimiquement pour le patient.
Grâce aux rayonnements émis par l'isotope radioactif lors de sa désintégration, on peut suivre son trajet dans le corps et donc s'assurer de la bonne santé du patient.
3) Une mesure de la radioactivité : l'activité
a. Un phénomène aléatoire
Un noyau instable va finir par se désintégrer pour donner un noyau plus stable, mais cette désintégration a lieu aléatoirement et la probabilité pour qu'un noyau se désintègre dans un intervalle de temps donné est la même, quel que soit l'âge de ce noyau.
La radioactivité dans un échantillon est souvent le fait de milliards de noyaux, on a donc une désintégration statistique d'une proportion des noyaux dans un intervalle de temps donné.
III - Les transformations nucléaires
1) Davantage de précision
Jusqu'à présent, la précision avec laquelle la masse des nucléons était donnée nous permettait de considérer que mproton = mneutron.
En réalité, ces deux masses ne sont pas égales :
- mproton = 1.6726 × 10-27kg
- mneutron = 1.6749 × 10-27kg
Il est donc possible de calculer la masse d'un noyau d'hélium :
Or la masse mesurée du noyau d'hélium est : .
L'écart est faible : mais non négligeable : il est par exemple 25 fois supérieur à la masse des 2 électrons qui entourent le noyau d'4He en temps normal...
Comme expliquer cet écart entre théorie et réalité ?
2) Equivalence masse-énergie
En 1905, Einstein dans le cadre de sa nouvelle théorie de la relativité restreinte propose qu'énergie et matière sont intimement liées : une quantité d'énergie suffisamment importante peut créer de la matière, et inversement. La relation qui les lie est la plus connue de la physique :
E = m.c2
Avec :
- l'energie E en joules (J),
- la masse m en kilogrammes (kg),
- la vitesse de la lumière dans le vide c = 3 × 108m.s-1.
Cela permet d'expliquer l'écart trouvé entre m(4He)réel et m(4He)théorique : L'interaction forte liant les nucléons entre eux dans un noyau est une énergie énorme à l'échelle nucléaire.
Δm = m(4He)théorique et m(4He)réel représente donc l'équivalent masse de l'énergie liant les nucléons au coeur du noyau d'Helium 4.
Il est donc possible de convertir ce défaut de masse en énergie :
3) Transformations nucléaires naturelles
Il est possible qu'un noyau se désintègre naturellement car le nombre de ses nucléons n'est pas "équilibré".
En effet, si un noyau comporte généralement davantage de neutrons que de protons, un excès de neutrons ou au contraire un déficit va rendre le noyau instable : il est alors possible qu'un proton se transforme spontanément en neutron ou inversement. On parle de radioactivité β
Il est également possible que le noyau soit simplement trop gros, et il se séparera d'un noyau d'4He, soit de 2 protons et 2 neutrons.
Ce qui donne :
| Nom : | particule | Condition | Equation |
| Alpha (α) |
noyau d'hélium 4 |
Le noyau contient trop de nucléons | |
| Bêta- (β-) |
Électron |
Le noyau comporte un excès de neutrons : l'un d'eux se transforme en proton | |
| Bêta+ (β+) |
Positron |
Le noyau comporte un excès de protons : l'un d'eux se transforme en neutron |
Remarques :
- Le positron (ou positon) est l'antiparticule de l'électron
- L'antimatière n'est pas une imagination de science fiction : la physique actuelle prévoit que chaque type particule de matière ordinaire, possède son antiparticule, de même masse, mais de charge électrique opposée.
Ainsi le positron a une charge opposée à celle de l'électron et donc égale à celle d'un proton - En pratique ces réactions dégagent de l'énergie. Cette énergie se traduit par l'énergie cinétique des particules produites (elles se déplacent très vite) mais également par une émission d'ondes électromagnétiques dans le domaine gamma (γ)
- En étudiant l'énergie produite par la désintégration β les physiciens du début du XXèmes se rendent compte qu'il en "manque" : une partie de l'énergie semble diparaître lors de la désintégration !
Comme cela est contraire au principe de conservation de l'énergie, Wolfgang Ernst Pauli ne voit pas d'autre moyen que de supposer en 1931 l'existence d'une nouvelle particule, le neutrino de charge nulle et très difficile à détecter qui emporterait avec elle ce déficit d'énergie.
Bien que purement spéculative, cette particule finit par être découverte en 1956.
Comment savoir si le noyau est radioactif α, β+ ou β- ?
Il ne vous sera pas demandé de le deviner, cependant des diagrammes sont disponibles pour le savoir.
Par exemple, un petit programme que j'ai réalisé permet en cliquant sur un isotope instable de réaliser le "chemin" de désintégration jusqu'à un élément stable.
