Les médicaments
II - Les molécules présentes dans les médicaments
1) Les molécules et leur représentation
Ci-contre, la représentation de la molécule d'aspirine.
En noir, les atomes de carbone ; en rouge, les atomes d'oxygène et en blanc les atomes d'hydrogène.
Vous pouvez faire tourner la molécule sur elle-même en cliquant dessus et zoomer en utilisant la molette de la souris.
(désolé, le tactile n'est pas pris en charge !)
a) La formule brute
La formule brute d'une molécule indique la nature des atomes qui la constituent et le nombre de chacun de ces atomes. Ce nombre est précisé en indice, droite du symbole de ces atomes.
Exemple : La molécule d'aspirine ci-dessus comporte 9 atomes de carbones, 4 atomes d'oxygène et 8 atomes d'hydrogène. Sa formule brute est donc C9H8O4.
b) Les liaisons covalentes
Elles correspondent à la mise en commun par deux atomes de deux électrons, chaque atome fournissant un électron.
Elle est schématisée par un trait :
Exemple :Deux atomes d'hydrogène vont mettre en commun leur électron pour créer une liaison covalente et former ainsi une molécule de dihydrogène H2 :
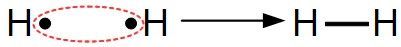
De même deux atomes d'oxygène mettront chacun deux électrons en commun pour former du dioxygène O2 :

c) Formules développée et semi-développée
Dans la formule développée, toutes les liaisons entre les différents atomes apparaissent.
Exemples :
le dioxyde de carbone CO2 : 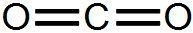
l'aspirine C9H8O4 :
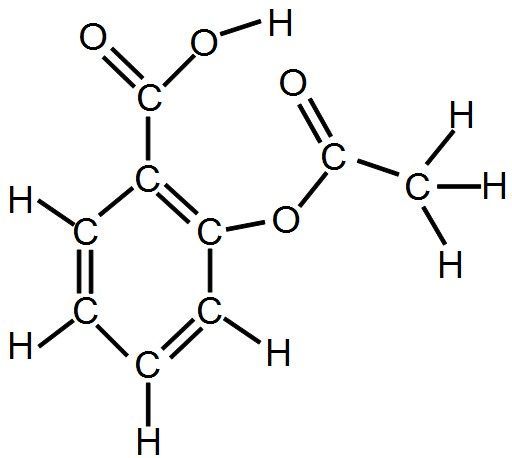
Exemple : l'aspirine devient
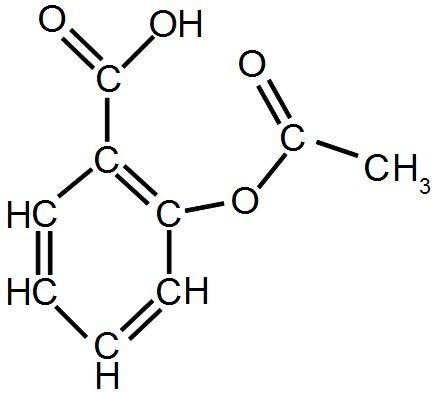
2) La représentation de Lewis
Grâce à cette représentation, il est possible de prévoir combien de liaisons covalentes chaque atome est capable de former.En effet, les atomes vont essayer de se rapprocher de la structure du gaz noble le plus proche en mettant en commun les électrons de leur couche externe (les couches internes ne comptent pas).
On va appliquer cette méthode à la molécule de dichlorométhane CH2Cl2, utilisée comme éluant dans le TP n°7.
- Je fais la liste de tous les atomes présents dans la molécule : Carbone C, hydrogène H, chlore Cl.
- J'écris la structure électronique de chaque atome :
- Carbone : (K)2(L)4
- Hydrogène : (K)1
- Chlore : (K)2(L)8(M)7
- Je cherche le nombre de liaisons covalentes que l'atome doit établir pour se rapprocher de la structure du gaz noble le plus proche : il correspond au nombre d'électrons à acquérir
- Carbone : il lui manque 4 électrons pour atteindre (L)8, il formera 4 liaisons covalentes
- Hydrogène : il lui manque 1 électron pour atteindre (K)2, il ne formera qu'une liaison covalente
- Chlore : il lui manque 1 électron pour atteindre (M)8, il ne formera qu'une liaison covalente
Je représente tous les atomes avec les points qui représentent leurs électrons externes 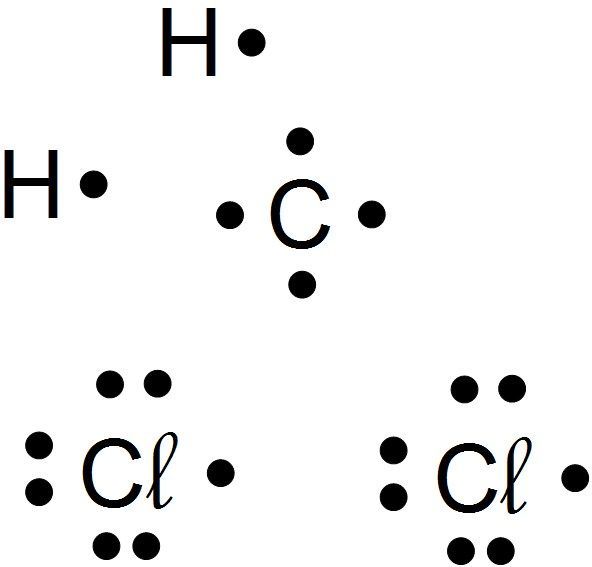
Je place les liaisons covalentes de façon à ce que tous les atomes en aient le bon nombre que qu'ils soient liés entre eux 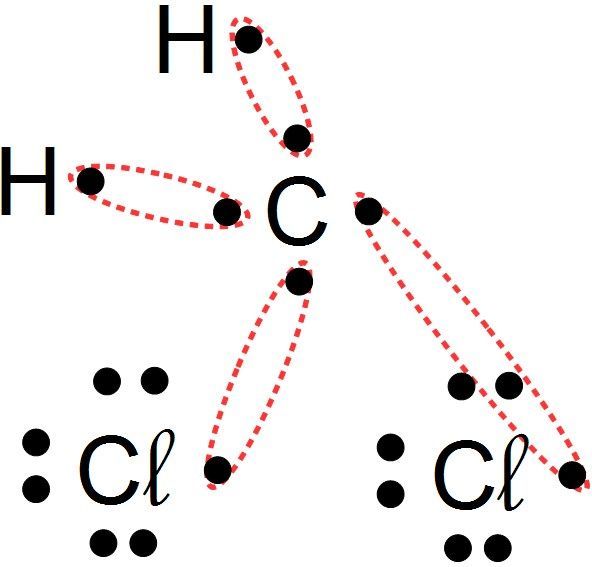
Finalement, je représente la formule brute : 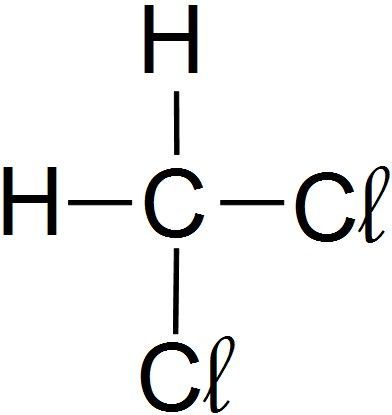
- d'une ou plusieurs substances ayant un intérêt thérapeutique appelée substance active (ou principe actif).
- d'une ou plusieurs substance n'ayant pas d'intérêt thérapeutique mais permettant de donner une forme (ex : amidon), un goût (ex : caramel) ou une couleur (ex : dioxyde de titane) au médicament. Elles sont appelées excipients.
- la nature et les quantités de réatifs et de solvants utilisés
- les règles de sécurité à respecter
- les montages réactionnels à utiliser
- l'ordre des étapes de séparation pour isoler la molécule fabriquée
- une étape de vérification de la nature de la molécule isolée (vérifier que l'on a bien isolé le roduit que l'on voulait fabriquer !)
- Dissolution du chlorure de sodium NaCl en ions chlorure Cl- et en ions sodium Na+ par l'eau :
- Dissolution du chlorure de cuivre (II) CuCl2 en ions chlorure Cl- et en ions cuivre (II) Cu2+ par l'eau :
- La concentration massique en soluté d'une solution indique la masse de soluté contenue dans 1L de solution.
- Le pourcentage massique en soluté indique la masse de soluté dissoute dans 100g de solution. Attention, il s'agit de la masse de la solution et non de la masse de solvant !
Si l'on dissout 10g de sel dans 100g d'eau, on a alors - Le pourcentage volumique en soluté indique le volume (en ml) de soluté dissout dans 100ml de solution. Attention, il s'agit du volume de la solution et non du volume du solvant !
Si l'on dissout 13ml d'éthanol dans 100ml d'eau, on aura une boisson alcoolisée à d'alcool en volume.
Il est possible que 2 molécules aux structures différentes partagent la même formule brutes : elles sont isomères l'une de l'autre.
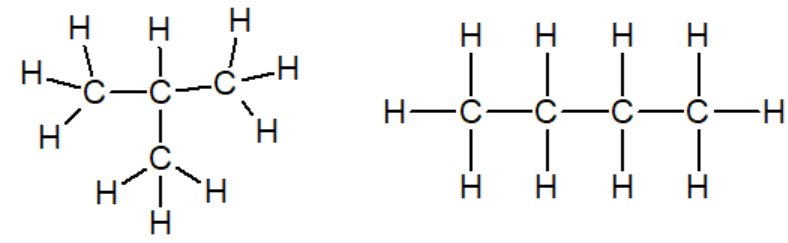
les molécules de méthylpropane et de butane sont isomères l'une de l'autre et ont pour formule brute C4H8.
III - Composition des médicaments
1) Lire une notice de médicament
a) Composition d'un médicament
Un médicament se compose généralement de deux choses :
| Exemple : | ||
| DCI | produits du commerce | |
| Paracétamol | Doliprane, Dafalgan, Efferalgan, Géluprane... | |
| Acide acétylsalicylique | Aspegic, Aspirine UPSA, Aspro, Kardegic... | |
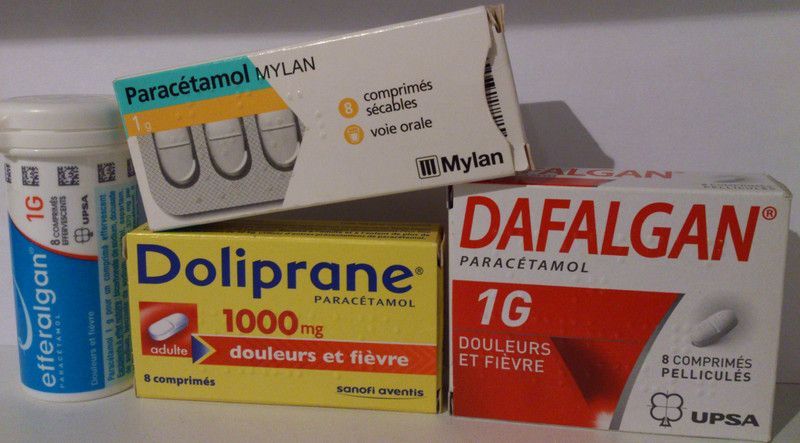
4 produits, une seule substance active : le paracétamol
b) Notice et boîte de médicament
D'un produit à l'autre et pour une même substance active, les excipients et la forme galénique (son aspect physique : forme, gélule, sirop, comprimé, suppositoire...) peuvent changer.
La posologie est la façon dont doit être administrée le médicament : à quelles quantitées (nombre de cuillères, de gouttes ...) et à quelle fréquence (une fois par jour, avant chaque repas ...).
Cette posologie est généralement précisée par le médecin préscripteur, mais dans le cas de l'utilisation d'un médicament sans ordonnance, il faut lire attentivement la notice, car les médicaments peuvent se révéler toxiques si les doses ne sont pas respectées !
c) Princeps et générique
Un médicament princeps (ou médicament de référence) est le médicament "historique" mis au point par un laboratoire, qui en garde l'exclusivité jusqu'à expiration du brevet. A ce moment les autres laboratoires ont alors le droit de produire des médicaments génériques contenant la même substance active.
Un médicament princeps et un médicament générique continnent le même principe actif mais peuvent différer par leur excipient ou leur forme galénique.
2) Carcatéristiques et identification d'une espèce chimique
On dispose de différentes méthodes pour identifier une espèce chimique :
a) Température de changement d'état
La matière existe sous différents états : solide, liquide ou gazeux. Le changement d'état correspond au passage d'un état à un autre.
La température d'ébullition est la température à laquelle cette espèce passe de l'état liquide à l'état de gaz. Sous une pression donnée, l'ébullition d'un corps pur se fait à une température constante, caractéristique de ce corps.
L'eau du tube restera liquide jusqu'à -3°C avant de geler brusquement à 1'50"
Les différents changements d'état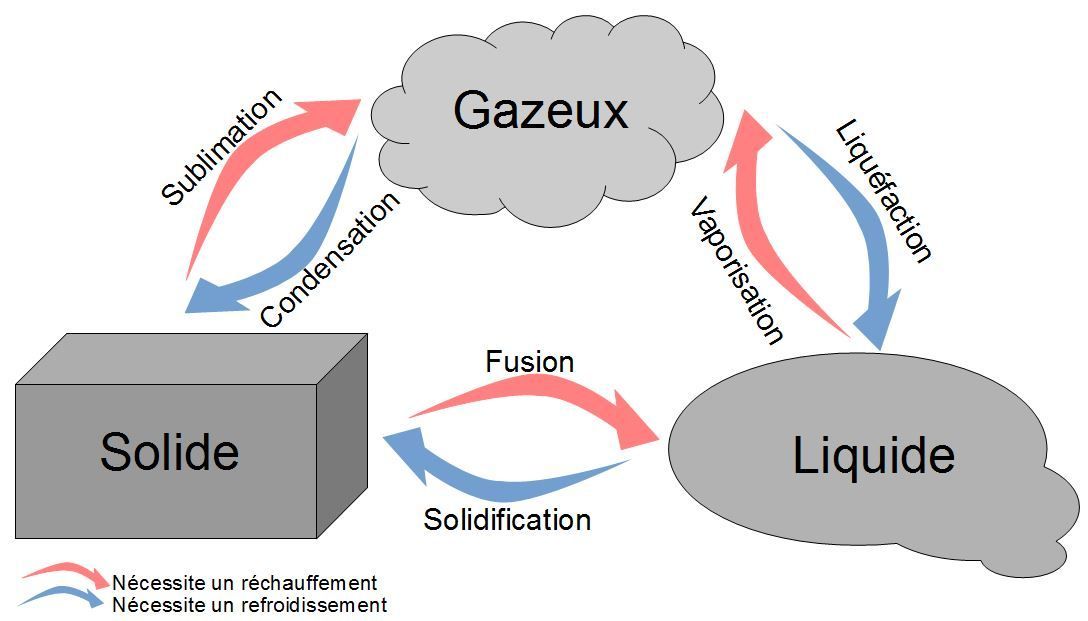
De même, la température de fusion est la température à laquelle un corps pur passe de l'état liquide à l'état solide.
L'inverse n'est pas forcément vrai : il est possible de garder de l'eau liquide en-dessous de sa température de solidification. On parle alors de surfusion
c) La solubilité
La solubilité d'une espèce chimique est la masse maximale (en g) de cette espèce que l'on peut dissoudre dans un litre de solution. Elle s'exprime en gramme par litre (g.L-1).d) La masse volumique
La masse volumique ρ (prononcer "rhô") d'une espèce chimique s'obtient en divisant la masse m d'un échantillon de cette espèce par son volume V.
ρ en kilogramme par mètre cube (kg.m-3)
m en kilogramme (kg)
V en mètres cube (m3)
IV - Synthèse d'un médicament
1) Méthode
a) La synthèse chimique au laboratoire
Grâce à la synthèse chimique, il est possible de produire des molécules existant dans la nature (mais en trop petite quantité ou trop chères à extraire) ou d'en créer des nouvelles (plastiques, savon, ...).
La chaîne de fabrication est généralement la suivante :

Synthétiser une espèce chimique consiste à fabriquer, à partir d'espèces chimiques de base, en effectuant des transformations chimiques qui comportent généralement plusieurs étapes, une nouvelle espèce chimique.
b) Protocole opératoire
Il sert de "recette" à la synthèse et précise :
| Entraînement à la vapeur Pour extraire un produit |
Chauffage à reflux Pour éviter les pertes de matière |
|
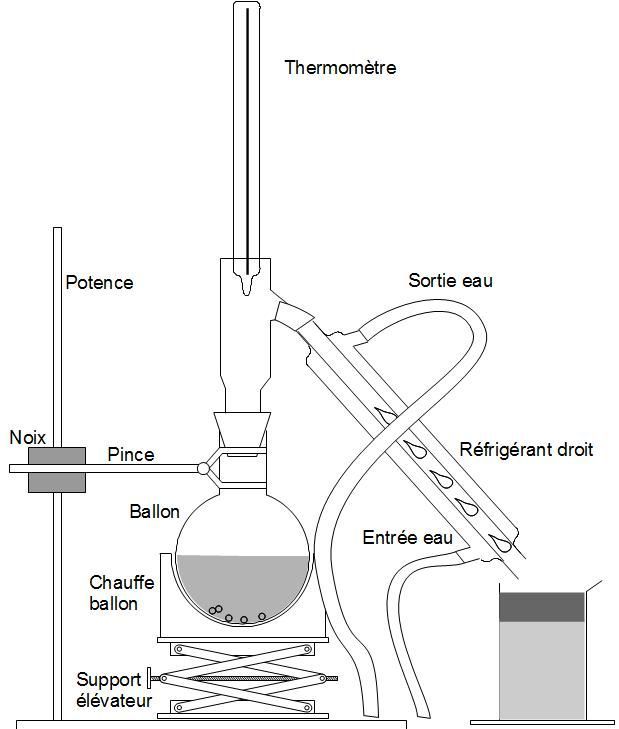 |
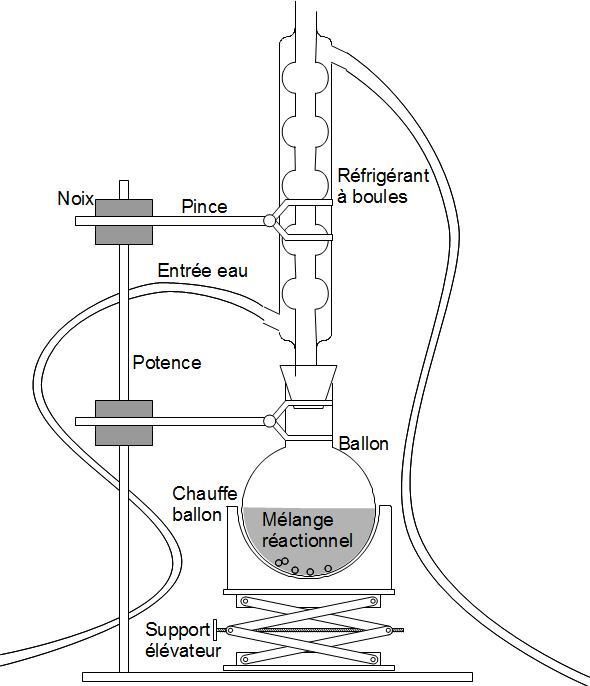 |
2) Solutions et dissolution
La quasi totalité des liquides présents dans la nature (eau de mer, sang, lait, sève, ...) et fabriquées par l'Homme (médicaments dissouts, détergents, boissons, ...) sont des solutions.
a) Solution, soluté, solvant
Une solution est un mélange homogène résultant de la dissolution d'une ou plusieurs espèces chimiques (le ou les solutés) dans une autre espèce chimique (le solvant). Si le solvant est l'eau, on parle de solution aqueuse.
b) Solutions moléculaires / solutions ioniques
Dans une solution moléculaire les molécules agrégées du solides sont simplement dispersées dans le liquide sans être modifiées.
Une solution moléculaire ne conduit pas mieux le courant que le solvant seul.
Exemple : la dissolution du saccharose.
Dans le cas d'une solution ionique, la dissociation du soluté par le solvant conduit à la formation d'ions dispersés dans ce dernier.
Comme le solvant et le soluté sont électriquement neutres la solution l'est également : le nombre totale de charges négatives doit donc rester égal au nombre total de charges positives.
Puisqu'une solution ionique contient des ions en solution, elle conduit d'autant mieux le courant électrique que les ions sont nombreux.
Exemples de dissolutions ioniques
c) Solubilité
Il n'est possible de dissoudre qu'une quantité limitée de soluté dans un solvant donné. Au-delà, le solution est à saturation et il n'est plus possible de dissoudre davantage de soluté.
La solubilité d'un soluté est généralement exprimée en g.L-1 et sa valeur dépend de la température.
On peut rendre soluble une espèce quasi insoluble dans un solvant en modifiant ses propriétés (pH par exemple). C'est le cas de l'aspirine qui devient soluble dans l'eau par ajout de bicarbonate de soude.
3) Grandeurs caractéristiques d'une solution
a) Masse et volume
Lors d'une dissolution la masse se conserve, revanche le volume de la solution préparée est en général plus grand que le volume du seul solvant.
b) Différentes concentrations
La concentration représente le rapport entre la quantité de soluté et la quantité de solvant utilisés dans la solution.
Selon les cas, on peut l'exprimer de différentes façons :

