Constitution de la matière
A. Description et caractéristiques de la matière à l'échelle macroscopique
0 - Rappels conversions & notations
a) Convertir la grandeur donnée dans l'unité demandée :
___ → ___
b) Convertir des durées
___h ___min ___s → s
c) Utiliser la notation scientifique
Convertir en notation scientifique :
___ = ×10.
Ecrire en notation décimale :
___×10___ = .
1 - Corps purs et mélanges au quotidien
a) Aspect visuel
Ci-dessous, huit photos d'un verre contenant des liquides divers. Comment pourrions-nous les classer en deux catégories par simple observation ?| 1 | 2 | 3 | 4 |
 |
 |
 |
 |
| 5 | 6 | 7 | 8 |
 |
 |
 |
 |
On voit que certains verres contiennent manifestement des mélanges : les photos 2, 3, 4. Pour les autres images, si le verre contient un mélange, il n'est pas visible.
On peut donc créer deux catégories :
- La catégorie des mélanges homogènes dont les constituants ne sont pas visibles à l'oeil nu
- La catégorie des mélanges hétérogènes qui regroupe les mélanges dont plusieurs constituants sont visibles à l'oeil nu.
Remarque : certains mélanges peuvent sembler homogènes de loin et hétérogènes de près (comme par exemple le jus d'orange, dont la pulpe est visible de près).
b) Mélanges et corps purs
Rappel : Toutes les substances sont chimiques !
Parmi les exemples suivants, lesquels sont des corps purs ?

lait

eau en bouteille
 eau déminéralisée
eau déminéralisée
acétone

or 18 carats

or 24 carats

fourchette en inox

bicarbonate de soude

pâte à tartiner
2 - Comment identifie-t-on une espèce chimique ?
On peut caractériser une espèce chimique de différentes façons, que ce soit grâce à ses propriétés chimiques (réaction chimique avec une autre espèce) ou ses caractéristiques physique (masse volumique, température de changement d'état).
a) Masse volumique
La masse volumique ρ (prononcer "rhô") d'une espèce chimique s'obtient en divisant la masse m d'un échantillon de cette espèce par son volume V.
ρ en kilogramme par mètre cube (kg.m-3)
m en kilogramme (kg)
V en mètres cube (m3)
Remarque : : même si le kg.m-3 est l'unité du Système International, il est courant en chimique d'utiliser d'autres unités, comme le kg.L-1, le g.L-1, ou le g.cm-1. On passe facilement des unes aux autres en se rappelant que 1m3 = 1000L et que 1kg = 1000g.
On a donc :
1000 kg.m-3 = 1kg.L-1 = 1g.mL-1 = 1g.cm-3.
La masse volumique permet de distinguer 2 corps purs, cette valeur dépend des conditions de l'expérience, mais à température et pression ambiante, la valeur est généralement disponible sur Wikipédia.
Quelques masses volumiques de référence :
- air : 1.2 kg.m-3
- ethanol : 790 kg.m-3 = 790 g.L-1
- glace d'eau : 910 kg.m-3 = 910 g.L-1
- huile de tournesol : 920 kg.m-3 = 920 g.L-1
- eau : 1000 kg.m-3 = 1000 g.L-1 (définition initiale du kilogramme)
- aluminium : 2700 kg.m-3 = 2700 g.L-1
- fer : 7870 kg.m-3 = 7870 g.L-1
- cuivre : 8960 kg.m-3 = 8960 g.L-1
- plomb : 11350 kg.m-3 = 11350 g.L-1
- or : 21400 kg.m-3 = 21400 g.L-1
- osmium (métal le plus dense) : 22610 kg.m-3 = 22610 g.L-1
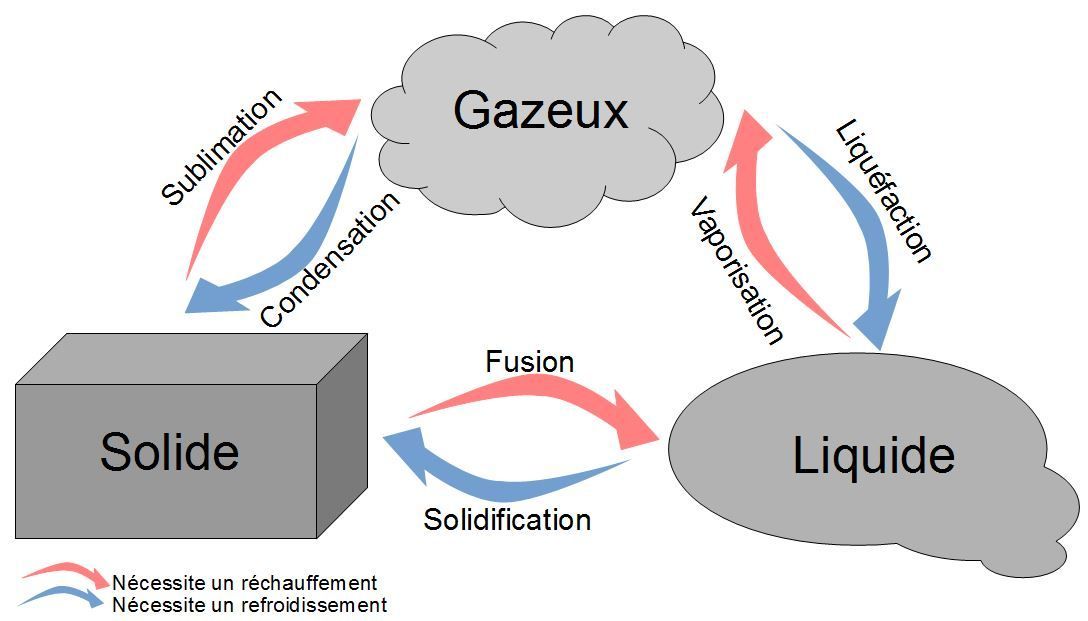
b) Température de changement d'état
La matière existe sous différents états : solide, liquide ou gazeux. Le changement d'état correspond au passage d'un état à un autre.
De même, la température de fusion est la température à laquelle un corps pur passe de l'état liquide à l'état solide.
L'eau du tube restera liquide jusqu'à -3°C avant de geler brusquement à 1'50"
Quelques températures de fusion de référence :
- azote : -219°C
- ethanol : -114°C
- mercure: -39°C
- eau : 0°C (définition initiale du degré centigrade)
- étain : 232°C
- plomb : 327°C
- aluminium : 660°C
- or : 1064°C
- fer : 1538°C
- tungstène : 3422°C
c) La chromatographie
Est-il possible de savoir si un colorant est pur ou bien s'il a été obtenu par un mélange de deux colorants différents ?
Un support sur lequel sont déposées les substances à étudier ou comparer a son extrémité trempée dans un solvant appelé éluant. L'éluant monte par capillarité le long du support et entraîne avec lui les substances étudiées à des "vitesses" qui leur sont propres. Si deux échatillons atteignent le même niveau, on peut considérer qu'ils sont constitués de la même substance chimique.
Il existe différentes méthodes de chromatographies. Elles sont couramment utilisées en laboratoire pour identifier certains composés et le procédé donne des résultats de qualité.
Nous avons réalisé une chromatographie sur couche mince, certes très grossière, mais qui nous permet de conclure sur la nature des colorants testés.
En effet, on voit sur la photo du résultat obtenu ci-contre que les taches de colorants bleu, jaune et rouge se sont déplacés le long du papier à des vitesses différentes. Le rouge n'a quasiment pas bougé, alors que le bleu a totalement quitté a ligne de dépôt.
Ces trois colorants se sont estompés, mais sont restés unis. En revanche dans le cas du colorant vert, la tache s'est dissociée en une tache bleue montant au même niveau que le colorant bleu et une tache jaune montant au même niveau que le colorant jaune.
Cela nous permet donc d'affirmer que non seulement le colorant vert est un mélange, mais qu'il a été obtenu en utilisant le colorant bleu et le colorant jaune que nous avons testés.
d) Les tests caractéristiques
Il est possible de caractériser certains gaz à l'aide de leur propriétés chimiques :Dans cette vidéo, le chimiste et vulgarisateur @brusicor02 vérifie grâce à ce test que le gaz produit est bien du dioxygène.
#LT (30/n)
Histoire de démontrer que c’est bien du dioxygène qui se dégage, j’ai refait l’expérience dans un tube à essai.
Approchons une bûchette incandescente et observons : la flamme se ravive, on a bien produit du dioxygène.— brusicor
Que se passe-t-il ?
Le dioxygène est le gaz dans l'air responsable de la combustion des matériaux (c'est un comburant). En son absence, la combustion ne peut pas avoir lieu (et donc la bûchette s'éteindrait) et inversement, elle va devenir plus vive en présence d'une source de dioxygène.
C'est exactement ce qu'il se passe ici : l'augmentation de la luminosité de la bûchette traduit la production de dioxygène par la réaction.
Dans cette vidéo, je fais réagir de l'acide chlorhydrique sur de la paille de fer.
On peut deviner (la qualité de la vidéo trahit son âge) une effervescence dans le tube, caractéristique de la présence d'un gaz. en présentant une flamme de briquet à l'embouchure du tube, on voit une petite explosion accompagné d'un bruit sifflant, ressemblant à l'aboiement d'un chiot.
Que se passe-t-il ?
Le dihydrogène est un gaz extrêmement inflammable (c'est un combustible). Sa combustion est très rapide, tellement qu'elle va produire un bruit caractéristique que ne produit aucun autre gaz qui se consume. Ce sifflement, ou aboiement, est caractéristique du dihydrogène.
Dans cette vidéo, Nicolas Braneyre présente la réaction du dioxyde de carbone avec de l'eau de chaux et s'en sert pour montrer la présence de ce gaz dans les boissons pétillantes.
Que se passe-t-il ?
L'eau de chaux est une solution aqueuse saturée en hydroxyde de calcium [Ca2+,2HO-]. le dioxyde de carbone CO2 est très soluble dans l'eau et va réagir avec les ions Ca2+ pour donner du carbonate de calcium CaCO3. Cette espèce, très peu soluble dans l'eau va précipiter et former le voile blanchâtre dans la solution.
3 - Concentration en masse
a) Définitions
Dans cet exemple:
- l'eau est le solvant,
- le sucre est le soluté.
b) Une quantité par unité de volume
a) Wydia dissout un sucre (saccharose) dans sa tasse de café (300mL).
Quelle serait la dose équivalente de sucre qu'elle devrait mettre dans une bouteille de 1L pour avoir le même goût ?
Une étiquette de soda indique "Quantité de sucre pour 1L : 106g"
b) Sachant qu'un morceau de sucre a une masse de 6g, calculer le nombre de morceaux dissout dans un verre (15cL) de ce soda.
On souhaite préparer 50mL d'une solution sucrée de concentration en masse cm = 12,5g.
c) Déterminer la masse de sucre à peser
d) Indiquer le protocole expérimental
Exercice 2 : dilution
Yann verse 8g de sel dans son assiette de soupe (400mL).
a) calculer la concentration en masse de sel dans sa soupe en g.L-1.
Pas de chance, elle est trop salée. Il ajoute une louche (200mL) de soupe et touille.
c) Calculer la nouvelle concentration en masse.
- le corrigé : cliquer pour télécharger
La concentration en masse cm d'une espèce chimique en solution s'obtient en divisant la masse m de cette espèce présente par le volume V de la solution.
cm en grammes par litre (g.L-1)
m en grammes (g)
V en litres (L)
La solution obtenue aura une concentration cm=×10g.L-1.
Il est nécessaire de prélever un volume V=mL.
c) Dilution et concentration en masse
| Lors d'une dilution la masse de soluté ne change pas. Cela nous permet donc d'écrire : ou encore s'il s'agit de déterminer la concentration finale :
|
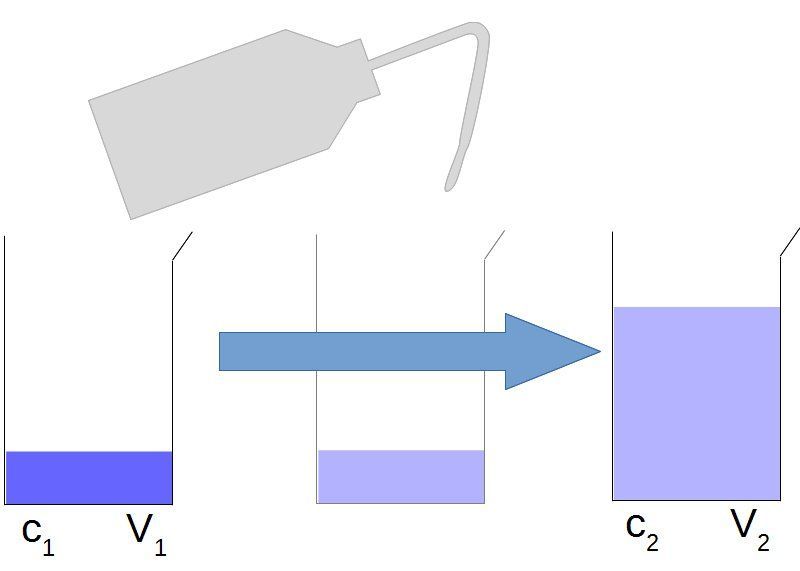 |
Quel volume V0 de cette solution faudrait-il prélever pour préparer un volume V1=__mL d'une solution S1 de concentration cm1=__×10__g.L-1 ?
Il est nécessaire de prélever un volume V0=mL.
4- Constitution de l'atome
a) Schéma
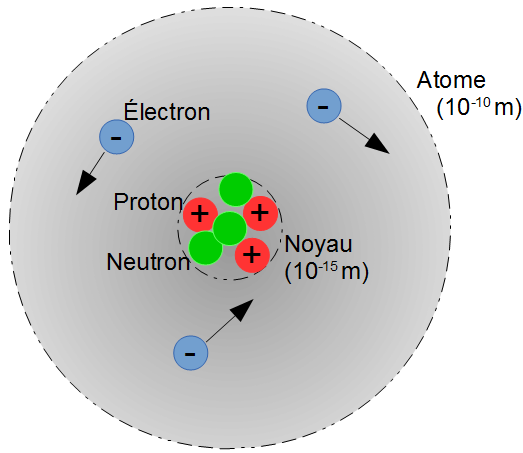
- Un atome est composé d'électrons tournant autour d'un noyau.
Dans le noyau se trouvent les protons et les neutrons : les nucléons - Les protons possèdent une charge électrique positive :
1,6x10-19C (coulomb). - Les électrons possèdent une charge électrique négative :
-1,6x10-19C (coulomb). - Les neutrons ne possèdent pas de charge électrique.
- Les protons et les neutrons ont à peu près la même masse :
mp ≃ mn = mnucléon = 1,67 × 10-27 kg. - Les électrons sont 1500 fois plus légers :
me = 9,1 × 10-31 kg.
b) Symbole du noyau
Les atomes sont classés en fonctions de leurs propriétés chimiques. Or, ces propriétés sont liées au nombre de protons présents dans le noyau.
Le nom d'un atome dépend uniquement du nombre de protons qu'il contient.
Si deux atomes ont le même nombre de protons mais un nombre de neutrons différent, ils sont dits isotopes du même élément.
Exemple : Le cuivre Cu est présent sous deux formes sur Terre, 63Cu contenant 34 neutrons et 65Cu avec 36 neutrons.
Le noyau atomique est représenté par un symbole :
Z : c'est le numéro atomique ou nombre de protons.
A : c'est le nombre de nucléons, appelé aussi nombre de masse.
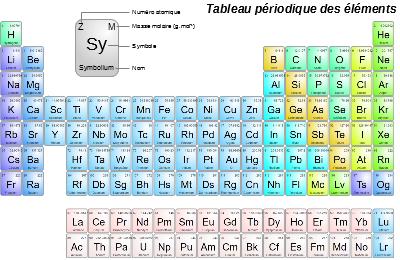
5- La classification périodique
La Classification périodique des éléments est un tableau classant l'ensemble des éléments chimiques existants.
L'intérêt de ce tableau est qu'il classe tout d'abord les éléments par numéro atomique Z croissant (c'est le nombre en haut à gauche dans la case).
Mais il les classe également par:
- groupe (les colonnes) : les éléments présents dans un même groupe ont des propriétés chimiques similaires,
- période (les lignes) : les éléments présents dans une même période ont le même nombre de couches électroniques.
Enfin, il indique une valeur appelée ici "masse atomique relative", que l'on retrouvera plus tard, mais qui pour le moment doit être considérée comme le le nombre de nucléons A de l'isotope majoritaire lorsque l'on arrondi ce nombre à l'unité.
c) Quelques exercices autour de l'atome
Z=.
C'est donc un atome de : .
Son numéro atomique Z vaut donc : et son nombre de nucléons : .
C'est donc un atome de : et son symbole est :
Sa masse est de : x10kg.
Sa représentation est donc :
Sa représentation est donc :
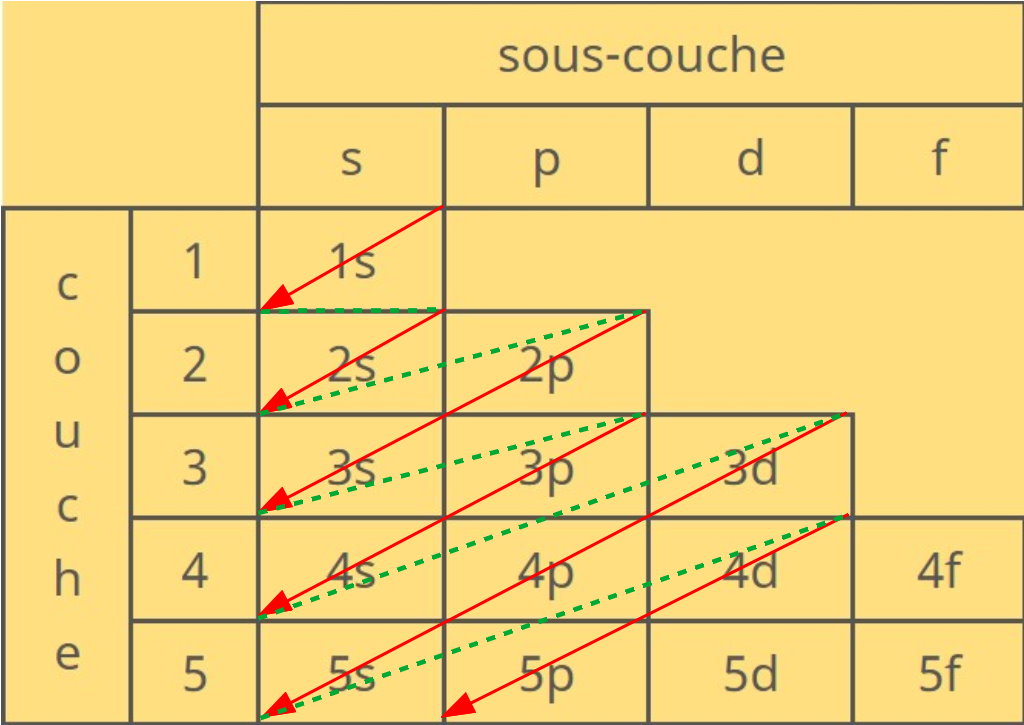
6- Le cortège électronique
Autour du noyau, les électrons se rangent en couches successives. A l'intérieur de ces couches, ils s'organisent en sous-couche| sous-couche | |||||
| s | p | d | f | ||
| c o u c h e | 1 | 1s | |||
| 2 | 2s | 2p | 3 | 3s | 3p | 3d | 4 | 4s | 4p | 4d | 4f |
| 5 | 5s | 5p | 5d | 5f | |
7- Formation des ions monoatomiques
- Un anion a gagné un ou plusieurs électrons et est donc chargé négativement.
exemple : F-, O2- - Un cation a perdu un ou plusieurs électrons et est donc chargé positivement.
exemple : Na+, Al3+
Les gaz nobles, une famille particulière
Les éléments appartenant à la famille des gaz nobles ont la particularité d'être inertes : cela signifie qu'il ne vont pas réaliser de réaction chimique.Les réactions chimiques ayant pour origine la structure du cortège électronique et particulièrement sa couche externe, on en conclut si les gaz nobles sont inertes, c'est que leur structure électronique de la forme s2 p6 est particulièrement stable.
La conséquence est que si un autre élément vient à perdre ou gagner suffisamment d'électrons pour se retrouver dans une structure similaire à celle d'un gaz noble, alors il la conservera et deviendra alors un ion, ce qu'il ne fera pas avec une autre structure.
Le gaz noble ayant la structure électronique la plus proche est le Néon avec 1s2 2s2 2p4.
⇒ L'atome d'oxygène va acquérir sa structure en capturant 2 électrons et en devenant l'ion O2-.
Le gaz noble ayant la structure électronique la plus proche est le Néon avec 1s2 2s2 2p4.
⇒ L'atome d'aluminium va acquérir sa structure en libérant 3 électrons et en devenant l'ion Al3+.