Transformations de la matière
1) Les molécules et leur représentation
a. le modèle moléculaire
Ci-dessus, la représentation de la molécule d'aspirine.
En noir, les atomes de carbone ; en rouge, les atomes d'oxygène et en blanc les atomes d'hydrogène.
On remarque également que les "traits" représentant des liaisons covalentes entre les atomes sont plus ou moins épais : il s'agit de laisons simples ou de liaisons doubles.
Vous pouvez faire tourner la molécule sur elle-même en cliquant dessus et zoomer en utilisant la molette de la souris.
(désolé, le tactile n'est pas pris en charge !)
b. Formules développées et semi-développée
Le modèle molécularie est utile lorsqu'il s'agit de manipuler la molécule, mais il est difficile à reproduire rapidement. Pour cette raison, on utilise en chimie 2 autres représentations :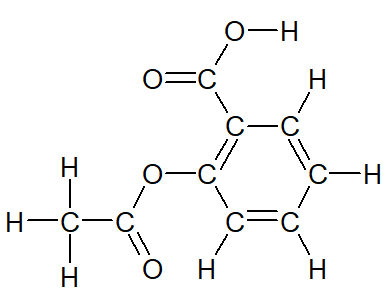 formule développée de l'aspirine |
La formule développée reprend le modèle moléculaire en remplaçant les boules colorées par le symbole de l'atome correspondant. |
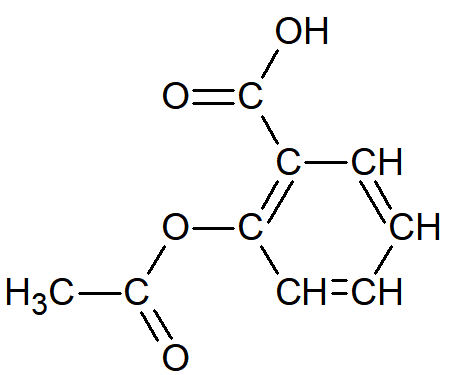 formule semi-développée de l'aspirine |
La formule demi-développée simplifie la représentation en "collant" chaque atome d'hydrogène à l'atome auquel il est lié. |
c. La formule brute
La formule brute d'une molécule indique la nature des atomes qui la constituent et le nombre de chacun de ces atomes. Ce nombre est précisé en indice, droite du symbole de ces atomes.Exemple : La molécule d'aspirine ci-dessus comporte 9 atomes de carbones, 4 atomes d'oxygène et 8 atomes d'hydrogène. Sa formule brute est donc C9H8O4.
Il est possible que 2 molécules aux structures différentes partagent la même formule brutes : elles sont isomères l'une de l'autre.
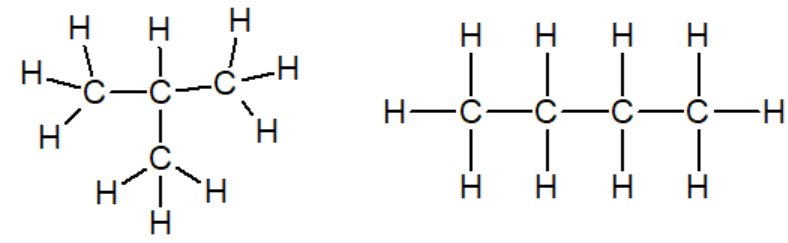
les molécules de méthylpropane et de butane sont isomères l'une de l'autre et ont pour formule brute C4H8.
b) Les liaisons covalentes
Elles correspondent à la mise en commun par deux atomes de deux électrons, chaque atome fournissant un électron.
Elle est schématisée par un trait :
Exemple :Deux atomes d'hydrogène vont mettre en commun leur électron pour créer une liaison covalente et former ainsi une molécule de dihydrogène H2 :
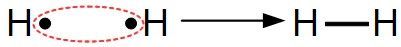
De même deux atomes d'oxygène mettront chacun deux électrons en commun pour former du dioxygène O2 :

2) Transformations physiques
La matière existe sous différents états : solide, liquide ou gazeux. Le changement d'état correspond au passage d'un état à un autre.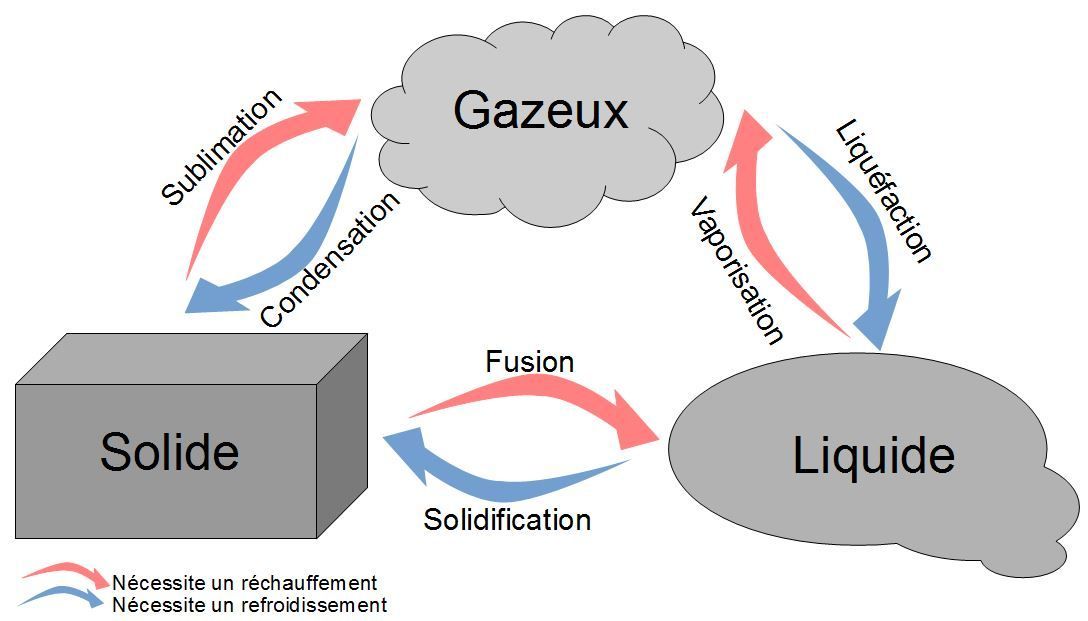
Les différents changements d'état
Cependant, on voit que la flamme continue de chauffer : elle continue donc de donner de l'énergie à l'eau. Toute cette énergie est utilisée pour transformer l'eau liquide en eau gazeuse (la vapeur d'eau).
3) Modéliser une transformation chimique
a) La recette de cuisine
Pour réaliser une quinzaine de crêpes, il vous faudra :- 250g de farine
- 0,5L de lait
- 3 oeufs
- Les coefficients en vert, que nous appelons proportions sont appelés coefficients stoechiométriques en chimie.
- Les ingrédients (à gauche) sont appelés réactifs.
- Les produits (à droite) sont appelés ... produits.
b) Application à la chimie
La combustion produit du dioxyde de carbone CO2 et de l'eau H2O.
➔Ecrire l'équation de réaction correspondante.
On l'écrit ensuite en utilisant les formules brutes :
Sous cette forme, on remarque qu'il n'y a pas le même nombre d'atomes d'hydrogène ou d'oxygène du côté des réactifs et des produits.
Le principe fondateur de la chimie moderne est la phrase célèbre d'Antoine de Lavoisier : "Rien ne se perd, rien ne se crée, tout se transforme"
Appliqué aux réactions chimiques, cela indique qu'il doit nécessairement y avoir autant d'atomes de chaque espèce du côté des réactifs et des produits.
Si ce n'est pas le cas, c'est soit que la "recette" de la transformation est incomplète, soit que les "proportions" ne sont pas les bonnes. On va donc ajouter les coefficients stoechiométriques nécessaires à la conservation de la matière :
- On écrit la réaction avec les formules brutes des substances, les réactifs à droite et les produits à gauche
- On ajuste les coefficients stoechiométriques si nécessaires, en commençant par les atomes qui n'apparaissent qu'une seule fois
Ajuster les équations suivantes :
- CO(g) +O2(g) → CO2(g)
- I2(g)+SO42−(aq) → I−(aq)+S2O82−(aq)
- CO(g)+NO(g) → CO2(g)+N2
- CH3OH(l)+O2(g) → CO2g)+H2O(l)
- Al(s)+O2 → Al2O3
- C6H6(g) +O2 → CO2+H2O(l)
- Cu2+(aq)+Al(s) → Cu(s)+Al3+(aq)
- C7H8(g)+O2 → CO2 +H2O(l)
- CO(g)+NO2 → CO2+N2
- Fe3+(aq)+I-(aq) → I2(g)+Fe(s)
- NO3−(aq)+Fe2+(aq)+H+(aq) → NO(g)+H2O(l)+Fe3+(aq)
4) Mole et quantité de matière
a) Une mesure du nombre d'atomes
Jusqu'à présent, on assimile la "quantité" d'un produit en fonction de la mesure de son volume ("je prends 1,5L de soda") ou de sa masse ("Je prends 800g de champignons").Pour les objets dénombrables, il est aussi possible d'en indiquer directement le nombre ("Je prends 3 croissants").
En chimie, s'il est relativement facile de prendre un volume ou une masse de substance donnée, on imagine qu'il est difficile de prendre un certain nombre d'atomes, car ceux-ci sont extrêmement petits et il est impossible de les compter un à un !
Il ne faut pas oublier que les Sciences Physiques ne fonctionnent jamais avec des mesures exactes, et qu'une connaissance approximative du nombre suffit.
 |
Amadeo Avogadro est le premier à avoir tenté d'évaluer le nombre d'atomes présents dans une quantité de matière donnée. NA = 6,02 x 1023 mol-1 Une mole d'objets est un "paquet" contenant 6,02 x 1023 objets. |
b) Une mesure du nombre d'atomes
Cela représente ×10mol.
c) Masse molaire atomique
La masse molaire atomique d'un atome est la masse d'une mole de cet atome pris à l'état naturel.Elle est notée M et s'exprime en gramme par mole (g.mol-1).
Compte tenu de la façon dont la mole a été définie, il se trouve que la masse molaire d'un élément est approximativement égale au nombre de nucléons (protons+neutrons) qu'il contient.
Le nombre de masse indiqué dans le tableau de classification de votre livre représente ce nombre de nucléons, en prenant en compte que pour certains éléments (comme le cuivre MCu=63,5g.mol-1 ou le chlore MCl=35,5g.mol-1) existent sous plusieurs formes isotopiques. Leur masse molaire atomique est donc une moyenne prenant en compte l'importance de chaque isotope
d) Masse molaire moléculaire
La Masse molaire moléculaire d'une molécule correspond à la masse d'une mole de cette molécule.Elle se calcule en faisant la somme des masses molaires atomiques des atomes qui composent cette molécule.
Exemple :La molécule de saccharose C12H22O11
Sa masse molaire vaut donc M = g.mol-1.
e) Masse d'un échantillon et quantité de matière
La masse m et la quantité de matière n d'un échantillon contenant une seule substance de masse molaire M se déduisent l'une de l'autre par les relations :| et | -n en moles (mol) -m en grammes (g) -M en grammes par mole (g.mol-1) |
__g de __ contient donc ×10 mol de __.
__×10__mol de __ a donc une masse de ×10 g.
Application :
i. Déterminer la quantité de matière de saccharose (C12H22O11) contenue dans un sucre de 3g.
ii. Calculer la masse de sucre en poudre à peser pour prélever 0,15 mol de saccharose.
5) Synthèse d'une espèce chimique
Différence naturel / synthèse
Une molécule de synthèse est indiscernable de la même molécule d'origine naturelle.

La composition chimique d'une banane naturelle
Pourquoi synthétiser un produit ?
- La molécule n'existe pas dans la nature
- une molécule naturelle existe, mais on veut améliorer ses propriétés
C'est le cas de l'aspirine, qui est une amélioration de l'acide salicylique présente dans l'écorce des saules (d'où son nom). Utilisée par les hommes depuis l'antiquité (et certains singes !) pour ses propriétés analgésiques, l'acide salicylique provoquait des douleurs à l'estomac.
L'aspartame est une molécule ayant un pouvoir sucrant 150 fois supérieure à celle du saccharose (sucre en poudre). Elle est utilisée dans les "sucrettes" et n'a aucun pouvoir nutritionnel.
Très largement utilisée dans les boissons "light", elle a depuis été ciblée par une campagne de défiance. Le consensus scientifique va pourtant dans le sens de son innocuité. - une molécule naturelle existe, mais il est plus économique de la synthétiser que de la cultiver.
C'est le cas de la vanilline.
Protocole opératoire
Il sert de "recette" à la synthèse et précise :- la nature et les quantités de réatifs et de solvants utilisés
- les règles de sécurité à respecter
- les montages réactionnels à utiliser
- l'ordre des étapes de séparation pour isoler la molécule fabriquée
- une étape de vérification de la nature de la molécule isolée (vérifier que l'on a bien isolé le produit que l'on voulait fabriquer !)
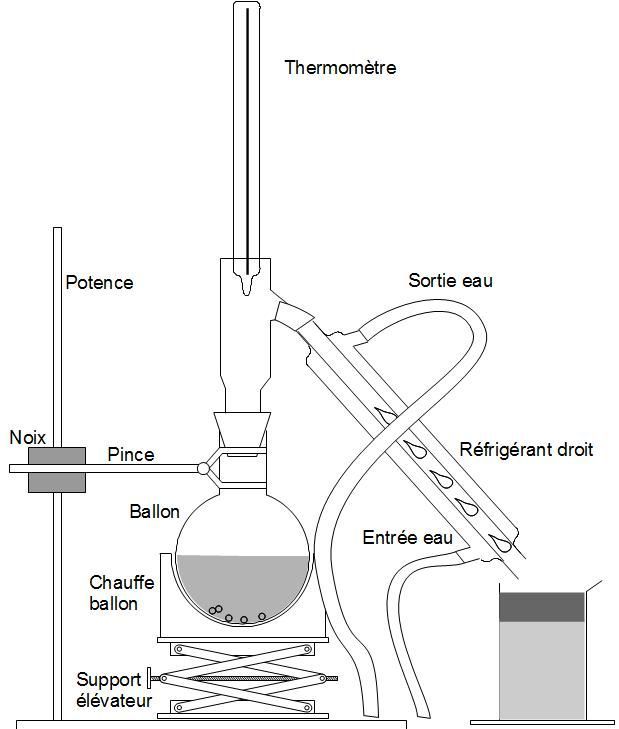
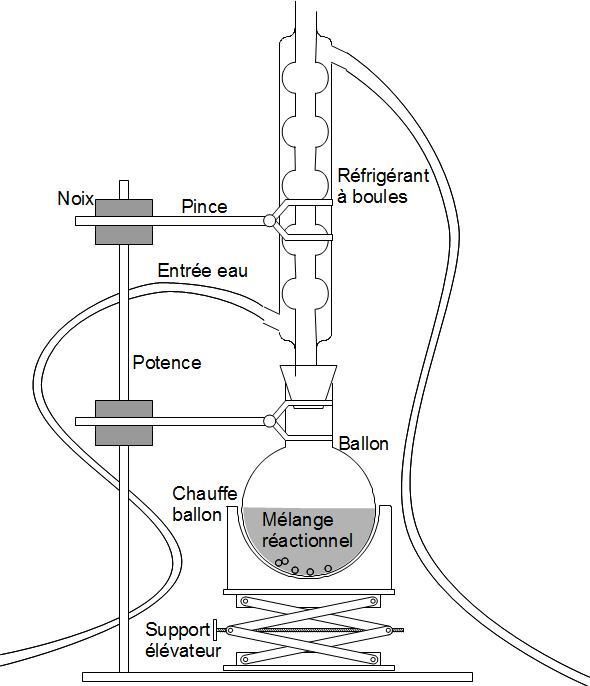
| Entraînement à la vapeur Pour extraire un produit |
Chauffage à reflux Pour éviter les pertes de matière |
|
 |
 |

6)Les transformations nucléaires
a. Rappels
Constitution de l'atome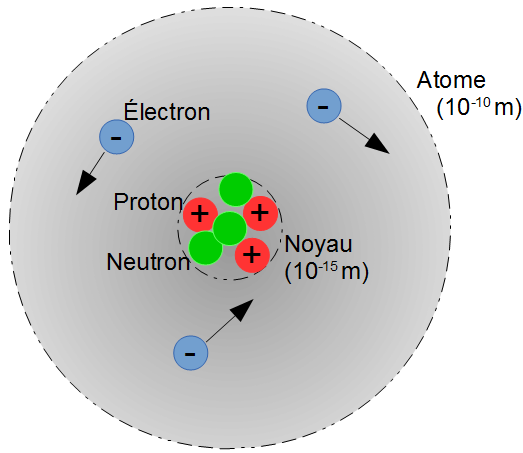
- Un atome est composé d'électrons tournant autour d'un noyau.
Dans le noyau se trouvent les protons et les neutrons : les nucléons - Les protons possèdent une charge électrique positive :
1,6x10-19C (coulomb). - Les électrons possèdent une charge électrique négative :
-1,6x10-19C (coulomb). - Les neutrons ne possèdent pas de charge électrique.
- Les protons et les neutrons ont à peu près la même masse :
mp ≃ mn = mnucléon = 1,67 × 10-27 kg. - Les électrons sont 1500 fois plus légers :
me = 9,1 × 10-31 kg.
Le noyau atomique est représenté par un symbole :
Z : c'est le numéro atomique ou nombre de protons.
A : c'est le nombre de nucléons, appelé aussi nombre de masse.
Exemple : Un noyau possède 27 nucléons dont 14 neutrons. Représenter son symbole.
Si deux noyaux ont le même nombre de protons, mais un nombre de neutrons différent (donc même Z mais A différents), alors ils sont appelés isotopes d'un même élément.
Ex : Le carbone compte 3 isotopes : 12C (98,93% du carbone sur Terre), 13C (1,07% du carbone sur Terre) et 14C (radioactif et présent à l'état de traces).
b. La radioactivité
Dans la nature, la plupart des noyaux sont stables, car l'interaction forte maintient dans le noyau les protons et les neutrons ensemble.
Cependant, certains noyaux comportant un trop grand nombre de protons par rapport aux neutrons, ou bien un trop grand nombre de neutrons par rapport aux protons voire une trop grande nombre de protons et de neutrons seront instables et se désintègreront spontanément en un nouveau noyau plus stable au bout d'un temps plus ou moins long en émettant un rayonnement sous forme de particules chargées et souvent, d'ondes électromagnétiques.
La radioactivité est la désintégration spontanée et aléatoire des noyaux atomiques instables en noyaux plus stables.
Un phénomène naturelAux origines de l'Univers, les seuls noyaux qui existaient étaient des noyaux d'hydrogène et d'hélium.
Tous les autres éléments ont été fabriqués par les premières générations d'étoiles, fusionnant progressivement les noyaux d'hydrogène et d'hélium pour donner tous les éléments que nous connaissons actuellement.
Ainsi, nous sommes tous constitués d'atomes produits il y a des milliards d'années dans la fournaise d'une étoile qui a explosé...
Les poussières et astéroïdes qui ont formés la Terre contenaient des éléments radioactifs et ce sont actuellement eux les principaux responsables de la radioactivité terrestre.
D'ailleurs, sans radioactivité naturelle, la Terre se serait refroidie depuis longtemps, car c'est elle qui explique à l'heure actuelle la température du centre de la Terre (5300°C).
La radioactivité est donc essentiellement un phénomène naturel.
La radioactivité artificielleDepuis une centaine d'années, l'Homme est capable de fabriquer des noyaux radioactifs par collision de particules dans des accélérateurs : on parle alors de radioactivité artificielle.
L'isotope radiocatif ayant exactement les même propriétés chimiques que l'isotope stable, il ne peut être dangereux chimiquement pour le patient.
Grâce aux rayonnements émis par l'isotope radioactif lors de sa désintégration, on peut suivre son trajet dans le corps et donc s'assurer de la bonne santé du patient.
c. Transformations nucléaires naturelles
Il est possible qu'un noyau se désintègre naturellement car le nombre de ses nucléons n'est pas "équilibré".
En effet, si un noyau comporte généralement davantage de neutrons que de protons, un excès de neutrons ou au contraire un déficit va rendre le noyau instable : il est alors possible qu'un proton se transforme spontanément en neutron ou inversement. On parle de radioactivité β
Il est également possible que le noyau soit simplement trop gros, et il se séparera d'un noyau d'4He, soit de 2 protons et 2 neutrons.
Ce qui donne :
| Nom : | particule | Condition | Equation |
| Alpha (α) |
noyau d'hélium 4 |
Le noyau contient trop de nucléons | |
| Bêta- (β-) |
Électron |
Le noyau comporte un excès de neutrons : l'un d'eux se transforme en proton | |
| Bêta+ (β+) |
Positron |
Le noyau comporte un excès de protons : l'un d'eux se transforme en neutron |
Remarques :
- Le positron (ou positon) est l'antiparticule de l'électron
- L'antimatière n'est pas une imagination de science fiction : la physique actuelle prévoit que chaque type particule de matière ordinaire, possède son antiparticule, de même masse, mais de charge électrique opposée.
Ainsi le positron a une charge opposée à celle de l'électron et donc égale à celle d'un proton - En pratique ces réactions dégagent de l'énergie. Cette énergie se traduit par l'énergie cinétique des particules produites (elles se déplacent très vite) mais également par une émission d'ondes électromagnétiques dans le domaine gamma (γ)
- En étudiant l'énergie produite par la désintégration β les physiciens du début du XXèmes se rendent compte qu'il en "manque" : une partie de l'énergie semble diparaître lors de la désintégration !
Comme cela est contraire au principe de conservation de l'énergie, Wolfgang Ernst Pauli ne voit pas d'autre moyen que de supposer en 1931 l'existence d'une nouvelle particule, le neutrino de charge nulle et très difficile à détecter qui emporterait avec elle ce déficit d'énergie.
Bien que purement spéculative, cette particule finit par être découverte en 1956.
Comment savoir si le noyau est radioactif α, β+ ou β- ?
Il ne vous sera pas demandé de le deviner, cependant des diagrammes sont disponibles pour le savoir.
Par exemple, un petit programme que j'ai réalisé permet en cliquant sur un isotope instable de réaliser le "chemin" de désintégration jusqu'à un élément stable.
d. Activité et demi-vie
Elle s'exprime en bequerels (Bq).
Pour caractériser la durée pendant laquelle un échantillon va rester radioactif, il nous faut une valeur indépendante de la taille de l'échantillon : la demi-vie.
Exemple :
La demi-vie du carbone 14 est de 5730 ans.
Si un échantillon contient 1000 noyaux de 14C il n'en contiendra plus qu'environ 500 au bout de 5730 ans et 250 au bout de 11460 ans.
Encadrer expérimentalement la demi-vie t1/2 de votre échantillon.
Nombre initial (conseillé : 500-10000) :Probabilité que le noyau se désintègre chaque année (conseillé : 0.05-0.3) :
Avec la probabilité choisie, la demi-vie de cette espèce est comprise entre ans ≤ demi-vie ≤ ans.

 indique que le produit est inflammable (ne pas le laisser à proximité d'une flamme ou d'une source de chaleur).
indique que le produit est inflammable (ne pas le laisser à proximité d'une flamme ou d'une source de chaleur).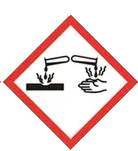 indique que le produit est corrosif : manipuler avec les protections adaptées (blouse, gants, lunettes).
indique que le produit est corrosif : manipuler avec les protections adaptées (blouse, gants, lunettes). indique que le produit est nocif : ne pas ingérer (évidemment), ne pas sentir, ne pas laisser au contact de la peau.
indique que le produit est nocif : ne pas ingérer (évidemment), ne pas sentir, ne pas laisser au contact de la peau.