Les piles
1. Quels sont les éléments indispensables au fonctionnement d'une pile ?
Voici une vidéo (publicité virale sur un produit Apple) trouvée sur Youtube :
Quels sont d'après vous les éléments indispensables à la fabrication d'une pile "maison" ?
Téléchargez ici le document de TP corrigé.
La vidéo ci-dessous présente l'expérience avec 4 métaux différents (cuivre, aluminium, fer et zinc) sur une pomme. Le voltmètre permet de mesurer la tension produite.
|
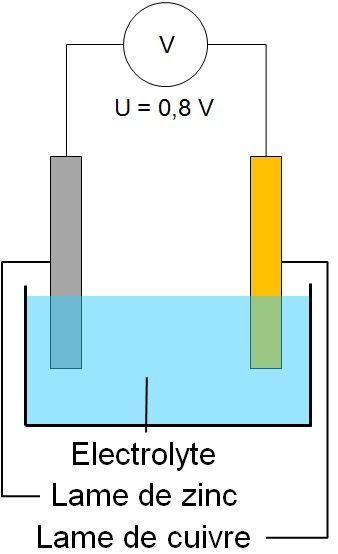
Définition Pour fabriquer une pile, il suffit d'utiliser 2 plaques de métal différentes (ex : fer et aluminium) et de les plonger dans une solution ionique (eau salée par exemple). |
|
2. Etude de la réaction entre les ions Cu2+ et le zinc
- Si l’on plonge une plaque de zinc dans une solution de sulfate de cuivre, celle-ci se recouvre d’un dépôt marron/orange : du cuivre. La réaction produit du cuivre métal.
- Si l’on plonge de la poudre de zinc dans du sulfate de cuivre, la température de la solution augmente brusquement. La réaction dégage une énergiez thermique.
- Lorsque l'on filtre la solution, on remarque que la couleur bleue a disparu, signe de la disparition des ions Cu2+.
- Quelques gouttes de soude font apparaître un précipité blanc, caractéristique de la rpésence d'ions Zn2+
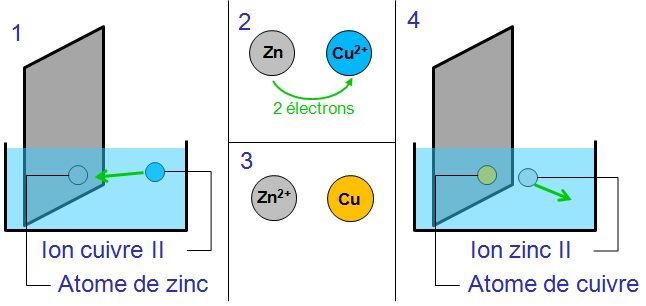
On peut donc écrire que la réaction est :
Cu2+ + Zn ![]() Cu + Zn2+
Cu + Zn2+
Les ions cuivres Cu2+ présents dans la solution vont capter les électrons des atomes de zinc : le cuivre va devenir métal et le zinc partira sous forme d’ions Zn2+ dans la solution.
3. Fonctionnement d’une pile
Dans un circuit élexctrique, le courant est le résultat du déplacement des électrons.
Pour qu'une réaction chimique puisse donner du courant, il faut que des électrons soient échangés, ce qui est le cas dans la réaction entre le zinc et le cuivre.
De plus, il faut pouvoir "obliger" les électrons à passer à travers le circuit : ions cuivre Cu2+ et zinc ne doivent donc pas se trouver en contact.
|
Exemple de la pile Daniell Cette pile a été créée en 1836 par John Daniell. Cette pile utilise la réaction Lorsque la pile n’est pas branchée, les électrons ne peuvent pas circuler, la réaction n’a pas lieu. |
 |
4. Schéma d'une pile du commerce
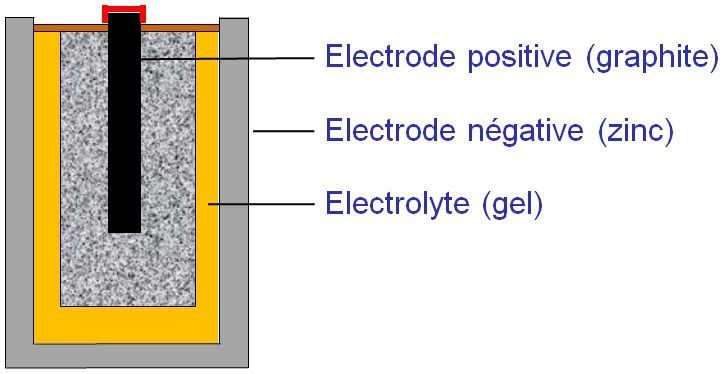 |
Remarque : On trouve dans le commerce des piles salines et des piles alcalines. Les piles alcalines stockent plus d’énergie. La différence vient de l’électrolyte qui est acide pour les piles salines et basique pour les piles alcalines. |
