Alcanes et alcools
VI- alcanes et alcools
1) Le squelette carbonné
Une molécule organique est structurée autour d'un ensemble d'atomes de carbone reliés ensembles par des liaisons simples ou multiples.
Ces atomes peuvent être liés de façon :
| linéaire | ramifiée | cyclique |
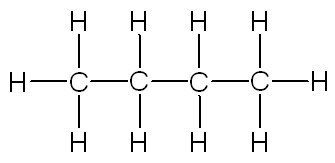 |
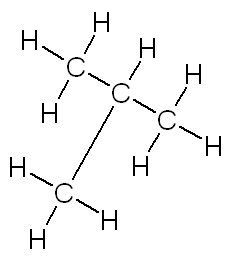 |
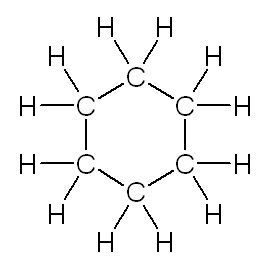 |
| butane | méthylpropane | cyclohexane |
Le préfixe indique le nombre d'atomes de carbone composant la chaîne principale :
| Nombre d'atomes de carbone | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | ... |
| Préfixe | méth- | éth- | prop- | but- | pent- | hex- | hept | oct- | ... |
- si la molécule ne contient que des atomes de carbones liés par des liaisons simples, elle fera partie des alcanes et son suffixe sera -ane,
- si la molécule contient au moins 2 atomes de carbone liés par une liaison covalente double, elle fera partie des alcènes et son suffixe sera -ène (on les a déjà rencontrés au chapitre isomérie Z/E),
- si la molécule contient un groupement hydroxyle -OH, elle fera partie de la famille des alcools et son suffixe sera -ol,
- ...
Si le squellette est ramifié, on ajoutera à sa dénomination le nom de chaque branche en fonction de sa longueur :
| Nombre d'atomes de carbone | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | ... |
| Préfixe | méthyl- | éthyl- | propyl- | butyl- | pentyl- | hexyl- | heptyl- | octyl- | ... |
Enfin, on précisera avant chaque branche sa position dans la chaîne carbonnée. Si la possibilité est unique, il est possible de ne pas le préciser. Cette position se définit en comptant le premier carbone comme étant celui qui va générer les positions les moins grandes.
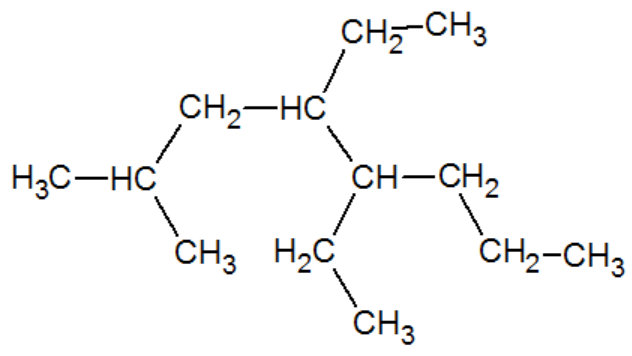
- la chaîne carbonnée la plus longue est entourée en rouge. Elle contient 8 atomes de carbone, donc la molécule s'appellera octane,
- il y a plusieurs ramifications, 2 contenant 2 atomes de carbone donc de type ethyl (on va donc appeler cela diethyl) et 1 avec un seul carbone donc methyl,
- On numérote la chaîne carbonnée pour pouvoir indiquer l'emplacement des ramifications (en vert),
- Cette molécule peut donc recevoir comme appellation 4,5-diethyl-2-methyloctane.
Exercice : nommer les molécules suivantes
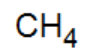 methane |
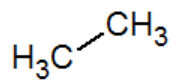 ethane |
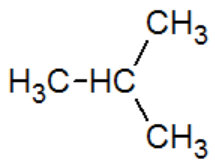 2-methylpropane |
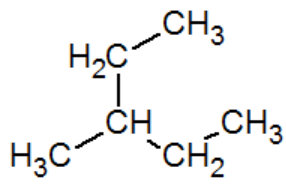 3-methylpentane |
 butan-2-ol |
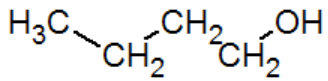 butan-1-ol |
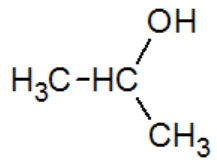 propan-2-ol" |
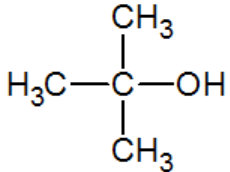 2-methylpropan-2-ol |
2) Structure et température de changement d'état
Regardons quelques caractéristiques de certaines molécules et essayons d'en tirer des conclusions :
| Molécule | Température de fusion (°C) | Température d'ébullition (°C) | Solubilité dans l'eau à 25°C (g.L-1) |
| méthane | -162.47 | -161.52 | 0.022 |
| éthane | -183.3 | -88.6 | 0.060 |
| propane | -187.6 | -42.1 | 0.075 |
| butane | -138 | -0.5 | 0.061 |
| pentane | -129 | 36 | 0.038 |
| methanol | -98 | 65 | miscible |
| ethanol | -114 | 79 | miscible |
| propan-1-ol | -127 | 97 | miscible |
| propan-2-ol | -88.5 | 82.5 | miscible |
| pentan-1-ol | -79 | 138 | 22 |
| fluorométhane | -137.8 | -78.4 | 22.7 |
| chlorométhane | -97.6 | 24.2 | 5 |
- Plus le squelette carbonné est long plus la température d'ébullition est élevée,
- A longueur équivalente, un groupement -OH augmente les températures de changement d'état,
- un groupement -OH permet de rendre miscible une molécule avec l'eau, pour peu qu'elle ne soit pas trop grosse,
- le fluorométhane a une plus grande solubilité dans l'eau que le chlorométhane, probablement grâce à sa capacité à établir des liaisons hydrogène avec les molécules d'eau.
3) Combustion des alcanes et alcools
a. Les alcanes
Le méthane CH4, propane C3H8 et butane C4H10 sont couramment utilisés comme gaz combustible.
Cependant, si l'on essaie d'écrire leur réaction de combustion dans le dioxygène de l'air, on se rend compte qu'il doivent produire de l'eau !
Cela est d'ailleurs confirmé par une expérience simple : approchez la flamme d'un briquet ou d'un feu de cuisson d'un verre à température ambiante : vour pourrez constater l'apparition de buée. L'eau produite sous forme de vapeur par la combustion se liquéfie au contact de la paroi froide du verre et forme la buée que l'on observe.
Les équations de transformation de la combustion de ces gaz dans le dioxygène de l'air doivent donc être :
b. les alcools

Depuis quelques années, il existe une véritable mode des cheminées au "bio-éthanol". Ces cheminées contiennent un réservoir d'éthanol (le terme "bio-éthanol" est un argument marketing soulignant l'aspect écologique de ce combustible comparé au pétrole, ce n'en est pas moins de l'éthanol) que l'on laisse progressivement brûler.
c. Aspects énergétiques
Les combustions sont des phénomènes qui dégagent de l'énergie sous forme de chaleur (réactions dites exothermiques). Cependant, tous les composés ne permettent pas de produire la même quantité d'énergie lors de leur combustion :
- 30 kJ.g-1 pour l'éthanol,
- 50 kJ.g-1 pour le méthane,
- 45 kJ.g-1 pour le butane,
- 47 kJ.g-1 pour l'essence.
L'éthanol produit donc notablement moins d'énergie par combustion que les alcanes, principalement parce que lors de sa combustion davantage d'eau est produite et qu'une partie de l'énergie de combustion sert à vaporiser cette eau produite.

Application : Chauffage
Comparer la quantité de CO2 produite par la combustion de 1kg butane et la masse d'éthanol correspondant au même dégagement d'énergie.
