Conduction électrique
I- Introduction
1. Quels sont les matériaux conducteurs ?
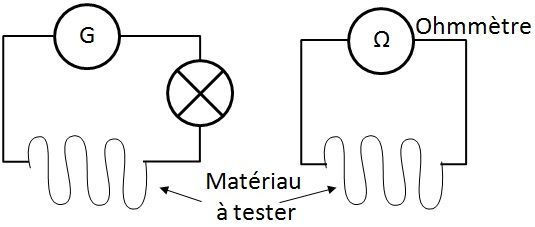
On peut tester la conductivité des matériaux à l'aide de deux méthodes :
| Méthode 1 | Méthode 2 |
 |
|
Résultats :
| Matériau | Méthode 1 | Méthode 2 |
| Fer | oui | oui |
| Cuivre | oui | oui |
| Mousse | non | non |
| Eau déminéralisée | non | non |
| Mine de crayon | oui | oui | Argent | oui | oui | Verre | non | non | Or | oui | oui |
| Bois | non | non |
| Plastique | non | non | Aluminium | oui | oui |
| Corps humain | non | oui | Zinc | oui | oui |
Remarque : Tous les métaux sont conducteurs, mais tous les conducteurs ne sont pas des métaux (ex : le graphite des mines de crayon) !
2. Utilisation des métaux
Les principaux métaux utilisés dans l'industrie sont les suivants :
| Métal | Caractéristique | Utilisation | image |
| Aluminium | Faible densité | Industrie aérospatiale |  |
| Argent | Le meilleur conducteur électrique | joaillerie, photographie, électronique |  |
| Cuivre | Couleur rouge/orangé | électronique |  |
| Fer | Attiré par un aimant | construction métallique |  |
| Or | Inaltérable, couleur jaune | joaillerie, monnaie, électronique |  |
| Zinc | protège le fer de la corrosion | protection du fer (galvanisation) |  |
Toutes les images sont issues des pages Wikipedia des métaux correspondants.
II- Un nouveau modèle de l'atome
1. Présentation
Pour expliquer la conduction des métaux, les atomes ne suffisent pas.
Il est nécessaire de faire l’hypothèse qu’ils contiennent une particule responsable de la conduction : l’électron.
Activité 2p39 :
- L'origine du mot atome provient du mot grec atomos qui signifie insécable. Cette définition n'est plus valable puisque l'on sait maintenant que l'atome contient plusieurs constituants
- Ces constituants sont le noyau au centre de l'atome et les électrons qui sont autour du noyau. Entre le noyau et les électrons, le vide compose la plus grande partie de l'atome.
- Il y a autant de charge positives à l'intérieur du noyaux que de charges négatives portées par les électrons : l'atome est donc globalement neutre.
- Chaque atome est caractérisé par le nombre de charges électriques qu'il contient
Schéma de l'atome :
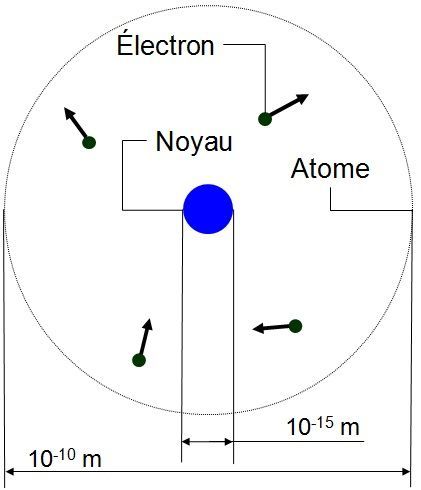 |
L'atome est constitué au centre d'un noyau qui regroupe toutes les charges positives. Autour de ce noyau se déplacent des électrons contenant chacun une seule charge négative. La quasi totalité de l'atome est constituée de vide : le noyau est 100 000 fois plus petit que l'atome : si le noyau était un ballon de 30 cm, l'atome ferait environ la distance Montpellier-Sète (30 km) |
2. L'électron et la conductivité électrique dans les solides
Dans un métal, les atomes sont empilés régulièrement.
Cela permet à certains électrons de « sauter » d'atome en atome.
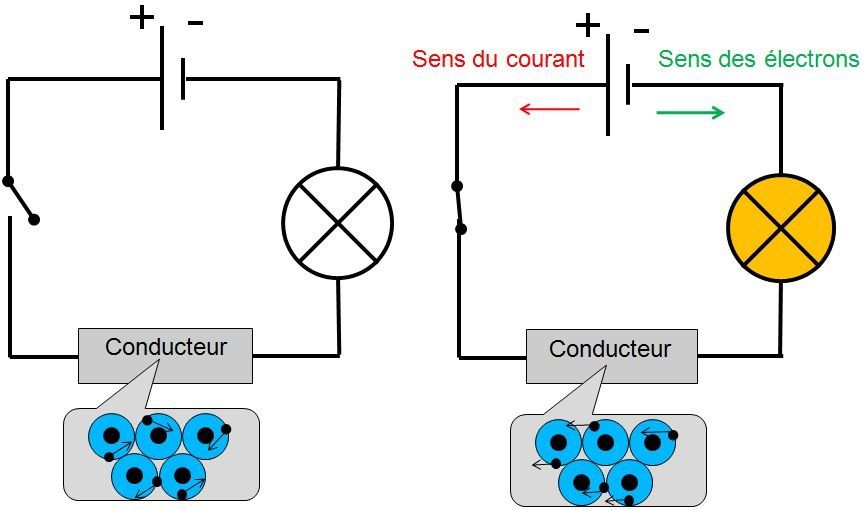
En temps normal les électrons se déplacent de façon aléatoire (au hasard) : c'est l'image de gauche.
En revanche, lorsqu'ils sont soumis à une tension, les électrons vont tous se déplacer dans une même direction : vers le pôle "+" du générateur (image de droite).
C'est ce déplacement des électrons qui va former le courant électrique.
Attention : les électrons circulent dans le sens inverse du sens conventionnel du courant.
3. Les ions et la conductivité électrique des solutions aqueuses
1) Qu'est-ce qui rend l'eau conductrice ?
- Lorsque l'on teste l'eau, on voit qu'elle ne conduit pas l'électricité :
=> les électrons ne peuvent pas circuler dedans. - Ni les cristaux de sel, ni les cristaux de sucre ne conduisent l'électricité
=> les électrons ne circulent pas non plus. - Lorsque l'on dissout du sel dans l'eau, celle-ci devient conductrice. Ce n'est pas le cas avec du sucre.
=>Seul le mélange sel/eau est conducteur : Il se forme dans l'eau salée des particules chargées électriquement qui transportent l'électricité. Appelons cette nouvelle espèce ion.
Comme l'eau et le sel sont initialement non conducteurs donc neutres électriquement, on en déduit qu'il y a dans le mélange autant d'ions chargés positivement (appelés cation) que d'ions chargés négativement (appelés anions).
Voici comment circulent les espèces chargées dans un circuit :
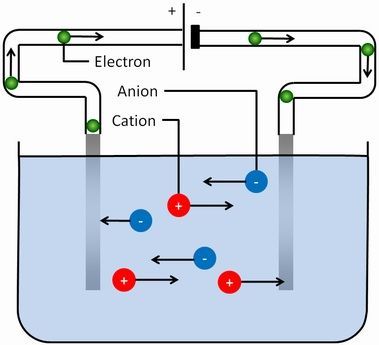
Remarque : les électrons ne circulent pas dans la solution et les ions ne circulent pas dans le circuit électrique.
4. Constitution et formule des ions
Un atome est électriquement neutre. La charge positive du noyau compense les charges négatives des électrons.
En gagnant au moins un électron, il va se charger négativement. Il deviendra un ion négatif ou anion.
Ex : l’ion chlorure Cl- est un atome de chlore qui a gagné un électron.
En perdant au moins un électrons, il va se charger positivement. Il deviendra un ion positif ou cation.
Ex : l’ion sodium Na+ est un atome de sodium qui a perdu un électron.
Si un ion perd/gagne plusieurs électrons, on notera le nombre d'électrons qu'il a perdu/gagné devant le signe.
Ex : l'ion Cuivre (II) a perdu 2 électrons, on le note Cu2+.
L'ion oxygène a gagné 2 électrons, on le note O2-.
Exercice :
Un ion possède 12 charges positives dans son noyaux et 10 électrons.
1) Représenter cet ion.
2) A quel atome correspond cet ion ?
2) Ecrire la formule de l'ion.
Réponse :
2) Dans le tableau de classification, les atomes sont rangs en fonction du nombre de charges positives de leur noyau.
L'atome qui a 12 charges positives est le magnésium (Mg).
3) Puisqu'il lui manque deux électrons, sa formule est Mg2+.
Les ions polyatomiques : La perte d'un ou plusieurs électrons peut arriver à un groupement d'atome. On conserve la même écriture.
Ex : L'ion permanganate MnO4- est responsable d'une forte couleur violette en solution aqueuse. Il est constitué d'un atome de manganèse Mn et de 4 atomes d'oxygène O.
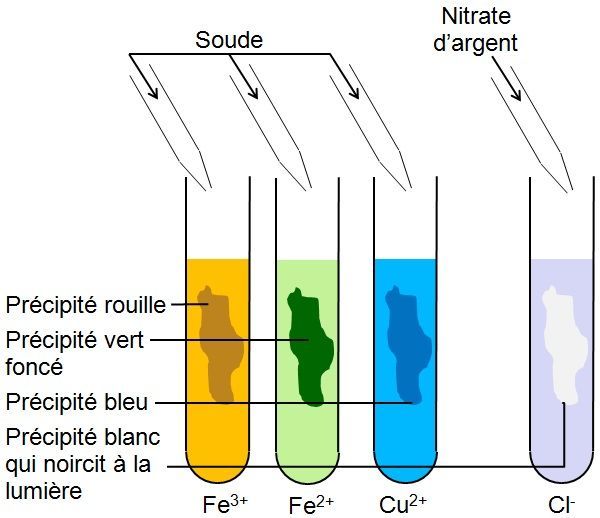
Le constituant de la soude qui permet l'identification des ions Cu2+, Fe2+, Fe3+ et Zn2+ est l'ion hydroxyde HO-.
5. Comment reconnaître les ions en solution ?
La soude et le nitrate d'argent nous permettent d'identifier certains ions.
| Formule de l'ion | Cl- | Cu2+ | Fe2+ | Fe3+ | Zn2+ |
| Détecteur | Nitrate d'argent | Soude | Soude | Soude | Soude |
| Couleur du précipité | Blanc Noircit à la lumière |
Bleu | Vert | Rouille | Blanc |